вода
- види води
- Хімічні назви води
- властивості
- агрегатні стани
- Ізотопні модифікації води
- Хімічні властивості
- Вода в природі
- Атмосферні опади
- дослідження води
- Гідрогеологія
- біологічна роль
- застосування
- Пиття і приготування їжі
- розчинник
- теплоносій
- сповільнювач
- пожежогасіння
- Спорт
- інструмент
- мастило
- Цікаві факти
- Див. такоже
- додаткове читання

загальні систематичне найменування оксид водню
вода [1] Традиційні назви вода Хімічна формула Н 2 O Фізичні властивості стан ( ст. ум. ) рідина молярна маса 18,01528 г / моль щільність 0,9982 г / см³ динамічна в'язкість ( ст. ум. ) 0,00101 Па · с
(При 20 ° C ) Кінематична в'язкість ( ст. ум. ) 0,01012 см² / с
(При 20 ° C ) Швидкість звуку в речовині 1348 м / с (дистильована вода) м / с Термічні властивості Температура плавлення 0 ° C Температура кипіння 99,974 ° C Потрійна точка 0,01 ° C, 611,73 Па критична точка 374 ° C, 22,064 МПа Питома теплоємність ( ст. ум. ) 75,37 Дж / (моль · К) теплопровідність ( ст. ум. ) 0,56 Вт / (м · K) Безпека токсичність
вода ( оксид водню ) - хімічна речовина у вигляді прозорої рідини , Яка не має кольори (В малому обсязі ), запаху і смаку (при стандартних умовах ). Хімічна формула : Н 2 O . В твердому стані називається льодом , снігом або інеєм, а в газоподібному - водяним паром . Близько 71% поверхні землі покрито водою ( океани , моря , озера , річки , льоди ).
Вода має ключове значення у створенні і підтримці життя на Землі, в хімічному будову живих організмів , В формуванні клімату і погоди . Є найважливішим речовиною для всіх живих істот на планеті земля .
види води
Вода на Землі може існувати в трьох основних станах - рідкому, газоподібному і твердому і набувати різних форм, які можуть одночасно бути сусідами один з одним: водяний пар і хмари в небі , морська вода і айсберги , льодовики і річки на поверхні землі, водоносні шари в землі. Вода здатна розчиняти в собі безліч органічних і неорганічних речовин. Через важливості води, «як джерела життя», її нерідко поділяють на типи за різними принципами.
За особливостями походження, складу або застосування, виділяють, в числі іншого:
- За ізотопами молекули:
Хімічні назви води
З формальної точки зору вода має кілька різних коректних хімічних назв:
властивості
Фізичні властивості
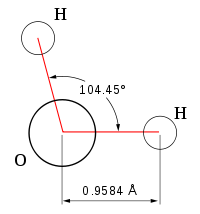
Вода в нормальних атмосферних умовах зберігає рідке агрегатний стан, тоді як аналогічні водневі сполуки є газами. Це пояснюється особливими характеристиками складають молекули атомів і присутністю зв'язків між ними. Атоми водню приєднані до атома кисню, утворюючи кут 104,45 °, і ця конфігурація строго зберігається. Через великий різниці електроотріцательностей атомів водню і кисню електронні хмари сильно зміщені в бік кисню. З цієї причини молекула води є активним диполем, де киснева сторона негативна, а воднева позитивна. В результаті молекули води притягуються своїми протилежними полюсами, і утворюють полярні зв'язку, на розрив яких потрібно багато енергії [2] . У складі кожної молекули іон водню ( протон ) Не має внутрішніх електронних шарів і має малі розміри, в результаті чого він може проникати в електронну оболонку негативно поляризованого атома кисню сусідньої молекули, утворюючи водневий зв'язок з іншою молекулою. Кожна молекула пов'язана з чотирма іншими за допомогою водневих зв'язків - дві з них утворює атом кисню і дві атоми водню [2] . Комбінація цих зв'язків між молекулами води - полярною і водневої і визначає дуже високу температуру її кипіння і питому теплоти пароутворення [2] . В результаті цих зв'язків у водному середовищі виникає тиск в 15-20 тис. Атмосфер, яке і пояснює причину трудносжімаемості води, так при збільшенні атмосферного тиску на 1 бар , Вода стискується на 0,00005 частки її початкового об'єму [2] [В яких межах зміни тиску коректна ця оцінка? ].
Структури води і льоду між собою дуже схожі [2] . У воді, як і в льоду, молекули намагаються розташуватися в певному порядку - утворити структуру, однак тепловий рух цьому перешкоджає. При температурі переходу в твердий стан тепловий рух молекул більш не перешкоджає утворенню структури, і молекули води впорядковуються, в процесі цього обсяги пустот між молекулами збільшуються і загальна щільність води падає, що і пояснює причину меншої щільності води в фазі льоду. При випаровуванні, навпаки, рвуться всі зв'язки. Розрив зв'язків вимагає багато енергії, від чого у води найбільша питома теплоємність серед інших рідин і твердих речовин. Для того щоб нагріти один літр води на один градус, потрібно затратити 4,1868 кДж енергії. Завдяки цій властивості вода нерідко використовується як теплоносій . Однак питома теплоємність води, на відміну від інших речовин непостійна: при нагріванні від 0 до 35 градусів Цельсія її питома теплоємність падає, в той час як у інших речовин вона постійна при зміні температури. Крім великої питомої теплоємності , Вода також має великі значення питомої теплоти плавлення (0 ° C і 333,55 кДж / кг) і пароутворення (2250 кДж / кг).
температура
° С Питома теплоємність води
кДж / (кг * К) -60 (лід) 1,64 -20 (лід) 2,01 -10 (лід) 2,22 0 (лід) 2,11 0 (чиста вода) 4,218 10 4,192 20 4,182 40 4,178 60 4,184 80 4,196 100 4,216
Вода має також високим поверхневий натяг серед рідин, поступаючись в цьому тільки ртуті [3] [4] [5] [6] . Відносно висока в'язкість води обумовлена тим, що водневі зв'язки заважають молекулам води рухатися з різними швидкостями.
За подібним причин вода є гарним розчинником полярних речовин. Кожна молекула розчиняється речовини оточується молекулами води, причому позитивно заряджені ділянки молекули речовини, що розчиняється притягують атоми кисню, а негативно заряджені - атоми водню. Оскільки молекула води мала за розмірами, багато молекул води можуть оточити кожну молекулу речовини, що розчиняється.
Це властивість води використовується живими істотами. У живій клітині і в міжклітинному просторі вступають у взаємодію розчини різних речовин у воді [7] . Вода необхідна для життя всіх без винятку одноклітинних і багатоклітинних живих істот на Землі.
Вода має негативний електричним потенціалом поверхні .
Чиста вода - хороший ізолятор . При нормальних умовах вода слабо диссоциирована і концентрація протонів (Точніше, іонів гидроксония H 3 O +) І гідроксильних іонів H O - становить 0,1 мкмоль / л. Але оскільки вода - хороший розчинник, в ній практично завжди розчинені ті чи інші солі, тобто у воді присутні позитивні і негативні іони. Завдяки цьому вода проводить електрику. За електропровідності води можна визначити її чистоту.
вода має показник заломлення n = 1,33 в оптичному діапазоні. Однак вона сильно поглинає інфрачервоне випромінювання, і тому водяна пара є основним природним парниковим газом , Що відповідає більш ніж за 60% парникового ефекту. Завдяки великому дипольному моменту молекул, вода також поглинає мікрохвильове випромінювання, на чому заснований принцип дії мікрохвильової печі .
агрегатні стани
за станом розрізняють:
при нормальному атмосферному тиску (760 мм рт. ст. , 101 325 па ) Вода переходить в твердий стан при температурі в 0 ° C і кипить (перетворюється на водяну пару) при температурі 100 ° C (температура 0 ° C і 100 ° C були спеціально обрані як температура танення льоду і кипіння води при створенні температурної шкали «за Цельсієм» в системі СІ ). При зниженні тиску температура танення (плавлення) льоду повільно росте, а температура кипіння води - падає. При тиску в 611,73 Па (близько 0,006 атм ) Температура кипіння і плавлення збігається і стає рівною 0,01 ° C. Такий тиск і температура називаються потрійною точкою води. При більш низькому тиску вода не може перебувати в рідкому стані, і лід перетворюється безпосередньо в пар. температура сублімації (сублімації) льоду падає зі зниженням тиску. При високому тиску існують модифікації льоду з температурами плавлення вище кімнатної.
З ростом тиску температура кипіння води зростає [8] :
Тиск, атм. Ткип, гр. Цельсія 0,987 (105 Па - нормальні умови) + 99.63 ° 1 + 100 ° 2 + 120 ° 6 + 158 ° 218,5 + 374,1 °
При зростанні тиску щільність водяної пари в точці кипіння теж росте, а рідкої води - падає. При температурі 374 ° C (647 K ) І тиску 22,064 МПа (218 атм ) Вода проходить критичну точку . У цій точці щільність і інші властивості рідкої і газоподібної води збігаються. При більш високому тиску немає різниці між рідкою водою і водяною парою, отже, немає і кипіння або випаровування.
Так само можливі метастабільні стани - пересичений пар, перегріта рідина , Переохолоджена рідина . Ці стани можуть існувати тривалий час, проте вони нестійкі і при зіткненні з більш стійкою фазою відбувається перехід. Наприклад, неважко отримати переохолоджених рідина, охолодивши чисту воду в посудині чистій нижче 0 ° C, однак при появі центру кристалізації рідка вода швидко перетворюється в лід.
Чиста вода здатна як переохолоджуватися не замерз до температури -33 ° C, так і бути перегріта до +200 ° C. За це її властивість вона отримала застосування в промисловості (наприклад в парових турбінах ).
Існує тип води, яка має щільність на 40% вище нормальної і закипає при температурі + 300 ° С. Цей різновид води була відкрита радянським ученим Б. В. Дерягиним на поверхні кристалів кварцу [2] .
Ізотопні модифікації води
І кисень, і водень мають природні і штучні ізотопи. Залежно від типу ізотопів водню, що входять в молекулу, виділяють наступні види води:
Останні три види можливі, так як молекула води містить два атоми водню. протій - найлегший ізотоп водню, дейтерій має атомну масу +2,0141017778 а.е.м., тритій - найважчий, атомна маса +3,0160492777 а.е.м.
за стабільним ізотопів кисню 16O, 17O і 18O існують три різновиди молекул води. Таким чином, за ізотопним складом існують 18 різних молекул води. Насправді будь-яка вода містить всі різновиди молекул.
Хімічні властивості
Вода є найбільш поширеним розчинником на планеті Земля, багато в чому визначає характер земної хімії, як науки. Велика частина хімії, при її зародженні як науки, починалася саме як хімія водних розчинів речовин. Її іноді розглядають, як амфоліт - і кислоту і підстава одночасно ( катіон H + аніон OH-). За відсутності сторонніх речовин у воді однакова концентрація гідроксид-іонів і іонів водню (або іонів гидроксония), pKa ≈ 16.
Вода хімічно досить активна речовина. Сильно полярні молекули води сольватіруются іони і молекули, утворюють гідрати і кристалогідрати . Сольволізу, і зокрема гідроліз , Відбувається в живій і неживій природі, і широко використовується в хімічної промисловості .
Вода реагує при кімнатній температурі:

- з фтором і межгалоіднимі сполуками


при низьких температурах 

- з солями , Освіченими слабкою кислотою і слабкою основою, викликаючи їх повний гідроліз

- з ангідридами і галогенангідриди карбонових і неорганічних кислот
- з активними металоорганічних сполуками (діетилцинк, реактиви Гриньяра, метілнатрій і т. д.)
- з карбидами , нитридами , фосфід , силіцидом , гідридами активних металів (кальцію, натрію, літію та ін.)
- з багатьма солями, утворюючи гідрати
- з боранів, силанами
- з кетен, недоокісью вуглецю
- з фторидами благородних газів
Вода реагує при нагріванні:


- з деякими алкилгалогенидами
Вода реагує в присутності каталізатора:
- з амидами, ефірами карбонових кислот
- з ацетиленом і іншими алкінілу
- з алкенами
- з нітрилом
Вода в природі
В атмосфері нашої планети вода знаходиться у вигляді крапель малого розміру, в хмарах і тумані , А також у вигляді пара . при конденсації виводиться з атмосфери у вигляді атмосферних опадів ( дощ , сніг , град , роса ). У сукупності рідка водна оболонка Землі називається гидросферой , А тверда кріосферу . Вода є найважливішим речовиною всіх живих організмів на Землі. Імовірно, зародження життя на Землі відбулося у водному середовищі.
Світовий океан містить більше 96% земної води, підземні води - близько 2%, льодовики - близько 2%, річки, озера, болота - 0,02% [Джерело не вказано 381 день] .
Атмосферні опади
Вода за межами Землі
Вода надзвичайно поширене речовина в космосі, проте через високий внутріжідкостного тиску вода не може існувати в рідкому стані в умовах вакууму космосу, від чого вона представлена тільки у вигляді пари або льоду.
Одним з найбільш важливих питань, пов'язаних з освоєнням космосу людиною і можливості виникнення життя на інших планетах , Є питання про наявність води за межами Землі в досить великій концентрації. Відомо, що деякі комети більше, ніж на 50% складаються з водяного льоду. Не варто, втім, забувати, що не будь-водне середовище придатна для життя - зокрема, акумуляторна батарея містить 25% розчин сірчаної кислоти в воді (але життя в ньому, очевидно, малоймовірна [Джерело не вказано 515 днів] , Тим більше, її виникнення).
В результаті бомбардування місячного кратера , проведеного 9 жовтня 2009 року НА СА з використанням космічного апарату LCROSS , Вперше були отримані достовірні свідчення наявності на супутнику Землі водяного льоду в великих обсягах [9] .
Вода широко поширена в сонячній системі , Вона є майже всюди, навіть в атмосфері Венери присутня невелика кількість водяної пари. Наявність води (в основному у вигляді льоду) підтверджено на багатьох супутниках Юпітера і Сатурна: Енцеладі , Тефии , Європі , Ганімеді та ін. Вода присутня в складі всіх комет і багатьох астероїдів. Вченими передбачається, що багато транснептунові об'єкти мають в своєму складі воду.
Рідка вода, імовірно, є під поверхнею деяких супутників планет , Найбільш ймовірно, на Європі - супутнику Юпітера .
дослідження води
гідрологія
гідрологія - наука , Що вивчає природні води, їх взаємодія з атмосферою і літосферою , А також явища і процеси, в них протікають (випаровування, замерзання і т. П.).
Предметом вивчення гідрології є всі види вод гідросфери в океанах , морях , річках , озерах , водосховищах , болотах , Грунтових і підземних вод .
гідрологія досліджує круговорот води в природі , Вплив на нього діяльності людини і управління режимом водних об'єктів і водним режимом окремих територій; проводить аналіз гідрологічних елементів для окремих територій і землі в цілому; дає оцінку і прогноз стану і раціонального використання водних ресурсів; користується методами, застосовуваними в географії , фізики та інших науках. Дані гідрології моря використовуються при плаванні і веденні бойових дій надводними кораблями і підводними човнами .
Гідрологія підрозділяється на океанологию , гідрологію суші і гідрогеологію .
Океанологія підрозділяється на біологію океану , Хімію океану, геологію океану, фізичну океанологию, і взаємодія океану та атмосфери.
Гідрологія суші поділяється на гідрологію річок (Річкову гідрологію, потамологія), озероведеніе (лімнології) , болотознавство , гляциологию .
Гідрогеологія
Гідрогеологія (від грец. Ὕδωρ «водність» + геологія) - наука, що вивчає походження, умови залягання, склад і закономірності рухів підземних вод. Також вивчається взаємодія підземних вод з гірськими породами, поверхневими водами і атмосферою. У сферу цієї науки входять такі питання, як динаміка підземних вод, гідрогеохімія, пошук і розвідка підземних вод, а також меліоративна і регіональна гідрогеологія. Гідрогеологія тісно пов'язана з гідрологією і геологією, в тому числі і з інженерною геологією, метеорологією, геохимией, геофізиків та іншими науками про Землю. Вона спирається на дані математики, фізики, хімії та широко використовує їх методи дослідження. Дані гідрогеології використовуються, зокрема, для вирішення питань водопостачання, меліорації і експлуатації родовищ.
біологічна роль
Вода відіграє унікальну роль як речовина , Що визначає можливість існування і саму життя всіх істот на землі . Вона виконує роль універсального розчинника , В якому відбуваються основні біохімічні процеси живих організмів . Унікальність води полягає в тому, що вона досить добре розчиняє як органічні, так і неорганічні речовини, забезпечуючи високу швидкість протікання хімічних реакцій і в той же час - достатню складність утворюються комплексних сполук.
завдяки водневого зв'язку , Вода залишається рідкою в широкому діапазоні температур, причому саме в тому, що широко представлений на планеті Земля в даний час.
Оскільки у льоду щільність менше, ніж у рідкої води, вода в водоймах замерзає зверху, а не знизу. Утворився шар льоду перешкоджає подальшому промерзання водойми, це дозволяє його мешканцям вижити.
застосування
землеробство
Вирощування достатньої кількості сільськогосподарських культур на відкритих посушливих землях вимагає значних витрат води на іригацію , Що доходять до 90% в деяких країнах.
Пиття і приготування їжі
Живе людське тіло містить від 55% до 78% води, в залежності від ваги і віку. Втрата організмом людини більше 10% води може привести до смерті. Для нормального функціонування організму людини потрібно засвоїти близько 3 літрів води за день в залежності від температури і вологості навколишнього середовища, фізичної активності і т. Д.
розчинник
вода є розчинником для багатьох речовин. Вона використовується для очищення як самої людини, так і різних об'єктів людської діяльності. Вода використовується як розчинник в промисловості.
теплоносій
Серед існуючих в природі рідин вода володіє найбільшою теплоємністю. Теплота її випаровування вище теплоти випаровування будь-яких інших рідин, а теплота кристалізації поступається лише аміаку . В якості теплоносія воду використовують в теплових мережах , Для передачі тепла по теплотрасах від виробників тепла до споживачів. Воду в якості льоду використовують для охолодження в системах громадського харчування, в медицині. більшість атомних електростанцій використовують воду в якості теплоносія.
сповільнювач
У багатьох ядерних реакторах вода вікорістовується НЕ только в якості теплоносія, а й сповільнювач нейтронів для ефективного протікання ланцюгової ядерної Реакції . такоже існують важководні реактори , В якіх як сповільнювач вікорістовується важка вода .
пожежогасіння
В пожежогасінні вода часто використовується не тільки як охолоджуюча рідина, а й для ізоляції вогню від повітря в складі піни .
Спорт
Багатьма видами спорту займаються на водних поверхнях, на льоду, на снігу і навіть під водою. це підводне плавання , хокей , Човнові види спорту, біатлон та ін.
інструмент
Вода використовується як інструмент для розпушення, розколювання і навіть різання порід і матеріалів. Вона використовується в добувній промисловості, гірничій справі і у виробництві. Досить поширені установки з різання водою різних матеріалів: від гуми до сталі. Вода, що виходить під тиском кілька тисяч атмосфер здатна розрізати сталеву пластину завтовшки кілька міліметрів, або більш при додаванні абразивних частінок.
мастило
Вода застосовується як мастильний матеріал для змащення підшипників з деревини, пластиків, текстоліту, підшипників з гумовими обкладками і ін. Воду також використовують в емульсійних мастилах. [10]
Цікаві факти
- В середньому в організмі рослин і тварин міститься більше 50% води. [11]
- У складі мантії Землі води міститься в 10-12 разів більше, ніж кількість води в Світовому океані [12] .
- При середній глибині в 3,6 км Світовий океан покриває близько 71% поверхні планети і містить 97,6% відомих світових запасів вільної води.
- Якби на Землі не було западин і опуклостей, вода покрила б всю Землю шаром завтовшки 3 км [13] .
- Якби всі льодовики розтанули, то рівень води в земних океанах піднявся б на 64 м і близько 1/8 поверхні суші було б затоплено водою [14] .
- Морська вода при звичайній її солоності 35 ‰ замерзає при температурі -1,91 ° C [15] .
- Іноді вода замерзає при плюсовій температурі [16] .
- При певних умовах (усередині нанотрубок ) Молекули води утворюють новий стан, при якому вони зберігають здатність текти навіть при температурах, близьких до абсолютного нуля . [17]
- Вода відображає 5% сонячних променів, у той час як сніг - близько 85%. Під лід океану проникає тільки 2% сонячного світла.
- Синій колір чистої океанської води пояснюється виборчим поглинанням і розсіюванням світла в воді.
- За допомогою крапель води з кранів можна створити напругу до 10 кіловольт, досвід називається « крапельниця Кельвіна ».
- Існує наступна приказка з використанням формули води - H2O: «Чоботи мої того - пропускають H2O». Замість чобіт в приказці може брати участь і інша дірява взуття. [18] [19] [20]
- Вода - це одне з небагатьох речовин в природі, які розширюються при переході з рідкої фази в тверду (крім води, такою властивістю володіють вісмут , галій , германій і деякі з'єднання і суміші).
- Вода і водяна пара горять в атмосфері фтору фіолетовим полум'ям. Суміші водяної пари зі фтором в межах вибухових концентрацій вибухонебезпечні. В результаті цієї реакції утворюються фтороводород і елементарний кисень .
Див. такоже
Примітки
- ↑ англ. International Union of Pure and Applied Chemistry. Nomenclature of Inorganic Chemistry. IUPAC RECOMMENDATIONS 2005. RSC Publishing, 2005. - p. 306.
- ↑ 1 2 3 4 5 6 А. К. Ларіонов. Цікава гідрогеологія. - Москва: Надра, 1979. - С. 5-12. - 157 с.
- ↑ Властивості води. Фізичні властивості води
- ↑ Основні фізичні властивості води, водяної пари, льоду, снігу
- ↑ Коефіцієнти поверхневого натягу рідин
- ↑ Surface tension (англ.)
- ↑ Молекулярні перетворювачі енергії в живій клітині (Тихонов А.Н., 1997)
- ↑ П. І. Воскресенський Техніка лабораторних робіт. 9-е изд. Л .: «Хімія», 1970. С. 696-697
- ↑ Вода на Місяці: але звідки?
- ↑ Воскресенський В. А., Дьяков В. І. Глава 2. Мастильні речовини і їх фізико-хімічні властивості // Розрахунок і проектування опор ковзання (рідинна мастило): Довідник. - М.: Машинобудування, 1980. - С. 15. - (Бібліотека конструктора). - ISBN ББК 34.42, УДК 621.81.001.2 (031)
- ↑ Наука і техніка. Книги. Загадки простої води.
- ↑ Склад і природа минтая Землі
- ↑ біосфера Землі
- ↑ Загадки простої води
- ↑ Дайвінг: статті, каталог спорядження, навчання, магазини, клуби і центри
- ↑ Всеволод Арабаджи. Загадки простої води. 2001
- ↑ Science Daily (англ.)
- ↑ Глава 3. Хімічний зв'язок і будова молекул. - підручник з сайту alhimik.ru
- ↑ обладунки водника - опис спорядження з сайту sport.potrebitel.ru
- ↑ Бізнес на босу ногу - казахстанська загальнонаціональна газета «Мегаполіс»
додаткове читання
література
- вода // Енциклопедичний словник Брокгауза і Ефрона : У 86 томах (82 т. І 4 доп.). - СПб. , 1890-1907.
- Лосєв К.С. Вода. - Л.: Гидрометеоиздат, 1989. - 272 с.
- Жорес Медведєв . Яка вода краще
- Гідробіонти в самоочищення вод і біогенної міграції елементів. - М .: МАКС-Пресс. 2008. 200 с. Передмова члена-кор. РАН В. В. Малахова. (Серія: Наука. Освіта. Інновації. Випуск 9). ISBN 978-5-317-02625-7 .
- Про деякі питання підтримки якості води та її самоочищення // Водні ресурси. 2005. т. 32. № 3. С. 337-347.
- Андрєєв В. Г. Вплив протонного обменнного взаємодії на будову молекули води і міцність водневого зв'язку. Матеріали V Міжнародної конференції «Актуальні проблеми науки в Росії». - Кузнецьк 2008, т.3 С. 58-62.