§ 33. Випаровування рідин. Пари [1 975 Ковальов П.Г., Хліян М.Д.

При будь-якій температурі з поверхні рідини вилітає частина молекул, утворюючи над нею пар. Процес переходу речовини з рідкого стану в газоподібний називається паротворенням. Випаровування, що відбувається при будь-яких температурах з відкритої поверхні рідини, називається випаровуванням. Його швидкість залежить від роду рідини, величини її вільної поверхні, температури, зовнішнього тиску і наявності над рідиною потоку повітря, що відносить пар.
Догляд молекул з поверхні рідини при випаровуванні пов'язаний з витратою внутрішньої енергії на роботу виходу Ав, яку молекулі необхідно зробити для подолання сил молекулярного тяжіння і сил зовнішнього тиску. Ця робота здійснюється за рахунок кінетичної енергії молекул. Молекула покине рідина тільки в тому випадку, якщо її кінетична енергія буде дорівнює або більше роботи виходу: 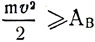 (M - маса молекули, v - складова швидкості молекули, спрямована перпендикулярно до поверхні рідини). При паротворенні рідина охолоджується, так як вилетіли молекули забирають частину її внутрішньої енергії.
(M - маса молекули, v - складова швидкості молекули, спрямована перпендикулярно до поверхні рідини). При паротворенні рідина охолоджується, так як вилетіли молекули забирають частину її внутрішньої енергії.
Щоб випаровування рідини відбувалося без зміни її температури, рідини необхідно повідомляти енергію. Скалярна величина, яка вимірюється кількістю енергії, необхідної для перетворення одиниці маси рідини в пару при постійній температурі, називається питомою теплотою пароутворення.
Для перетворення одиниці маси рідини в пару при постійній температурі їй повідомляється кількість теплоти, що дорівнює питомій теплоті пароутворення. При паротворенні відбувається збільшення обсягу речовини. Так, пари води при, 100 ° С займають обсяг майже в 1700 разів більше обсягу тієї ж маси води при 100 ° С. Тому речовина, випаровуючись, частина питомої теплоти пароутворення витрачає на здійснення роботи проти сили зовнішнього тиску, а частина - на збільшення його внутрішньої потенційної енергії. Тому при однаковій температурі внутрішня енергія одиниці маси речовини в газоподібному стані більше, ніж в рідкому. Так, 1 кг водяної пари при 100 ° С має на 2 * 106 дж внутрішньої енергії більше, ніж 1 кг води при тій же температурі.
Досліди показали, що питома теплота пароутворення речовини залежить від його температури. Чим вище температура речовини, тим менше його питома теплота пароутворення. Наприклад, при 0 ° С питома теплота пароутворення води 2499 кДж / кг, при 50 ° С - 2385 кДж / кг, при 100 ° С - 2257 кДж / кг, при 200 ° С - 1943 кДж / кг. Зменшення теплоти пароутворення пояснюється тим, що чим вище температура речовини, тим більше кінетична енергія його молекул і тим менше енергії потрібно додатково повідомити рідини, щоб її молекули вилетіли в навколишнє середовище.
Найменування питомої теплоти пароутворення r кг / дж. Для перетворення m кг маси рідини в пар треба певну кількість енергії, зокрема кількість теплоти Q = rm.
Припустимо, що рідина випаровується в закритій посудині. Частина молекул пара внаслідок теплового руху, наблизившись до поверхні рідини, повертається в неї. У закритій посудині одночасно відбувається і процес випаровування і процес конденсації Якщо число молекул, що вилетіли з рідини, більше числа молекул, які повернулися в неї, то пар над рідиною називається ненасиченим. Досліди з ненасиченими парами показали, що вони підкоряються газовим законам.
В процесі випаровування і конденсації настає такий момент, починаючи з якого число молекул, що вилетіли з рідини в одиницю часу, виявиться дорівнює кількості молекул, які повертаються назад в рідину, тобто настане динамічна рівновага між рідиною і парою. Пар, що знаходиться в динамічною рівновагою зі своєю рідиною, називається насиченою парою. Він може бути насиченим не тільки в закритій посудині, а й в атмосфері. Так, при тумані пари води в повітрі насичені.
Відкриємо кран А (рис. 35) і впустимо в колбу кілька крапель ефіру, який випаровується, утворюючи ненасичений пар. Чим більше ефіру ми впускаємо в колбу, тим більше стає тиск його ненасиченого пара. Ефір впускаємо до тих пір, поки на дні колби виявиться трохи рідкого ефіру. Поява останнього вказує на те, що пари ефіру стали насиченими. З цього моменту манометр перестає показувати збільшення тиску - воно стало постійним, незважаючи на подальше додавання ефіру. Отже, тиск і щільність парів при даній температурі найбільша, коли пар насичений.
Якщо в колбу поміщати по черзі різні рідини і вимірювати тиск їх насичених парів, то виявляється, що при одній і тій же температурі тиск насичених парів різних рідин різна. Найбільшим тиском мають пари ефіру, меншим - пари спирту і ще меншим - пари води.
При температурі 20 ° С тиск насичених парів цих рідин одно (в мм рт. Ст.):
З'ясуємо, чи залежить тиск насиченої пари при постійній температурі від його обсягу. Під поршнем в циліндрі, з'єднаному з манометром, знаходиться рідина і її насичена пара (рис. 36). Змінюючи його обсяг переміщенням поршня вгору, а потім вниз, за показаннями манометра бачимо, що при постійній температурі тиск насиченої пари від об'єму не залежить, і воно при даній температурі для даної рідини є величина постійна. Це означає, що насичені пари закону Бойля-Маріотта не підкоряються. Так, манометр парового котла при даній температурі показує завжди одне і те ж тиск, незалежно від того, який обсяг займає в ньому насичена пара.
Пояснюється це тим, що при зміні обсягу насиченої пари відбувається зміна його маси. Прічувеліченіі обсягу маса пара збільшується (відбувається додаткове випаровування рідини), при зменшенні обсягу маса пара зменшується (частина його конденсується).
З'ясуємо, чи залежить при постійному обсязі тиск насиченої пари від його температури. Нагріємо насичений пар в колбі (див. Рис. 35), помістивши її в гарячу воду. Бачимо, з підвищенням температури тиск насиченої пари збільшується. Наприклад, тиск насиченої пари води при 50 ° С дорівнює 92,5 мм рт. ст. , А при 100 ° С - 760 мм рт. ст.
Досліди і розрахунки по зміні тиску насиченої пари від нагрівання показують, що тиск збільшується в багато разів більше, ніж мало б бути за законом Шарля, т. Е. Залежність тиску від температури не підкоряється цьому закону. Пояснюється це тим, що тиск насиченої пари при нагріванні зростає, по-перше, внаслідок збільшення середньої кінетичної енергії молекул цього пара і, по-друге, через збільшення концентрації молекул пара, т. Е. Збільшення загальної маси молекул.
Поки пар залишається насиченим, зміна його температури або обсягу завжди супроводжується зміною маси пара, тобто паротворенням, або конденсацією.
Властивість насичених парів води збільшувати свій тиск з підвищенням температури застосовується в парових котлах для отримання пара, що має великий тиск, наприклад 100 ат, при температурі кипіння води 310 ° С. Для використання пара в парових машинах його відводять з котла, нагрівають, перетворюють в ненасичений . Такий пар називається перегрітою, він має великий запас внутрішньої енергії. Якщо пара не перегрітий, то він містить крапельки рідини.
Отримавши в пробірці пари ефіру, почнемо охолоджувати їх, помістивши її в суміш льоду і солі. На стінках пробірки з'являється наліт рідкого ефіру, так як при охолодженні його пари перетворилися в рідину. Існує два способи звернення пара в рідина: збільшення тиску на пар, стиснення його (див. Рис.36) і зниження температури пара, охолодження його. Досліди показують, що і гази можна перетворити в рідину (скраплення газів). Для цього їх треба одночасно і стискати і охолоджувати, поки вони не перетворяться в рідину.